Anvisa recebe pedido de uso emergencial do Butantan para liberar Coronavac
- porJuliano Beppler da Silva
- 8 de janeiro de 2021
- 3 anos
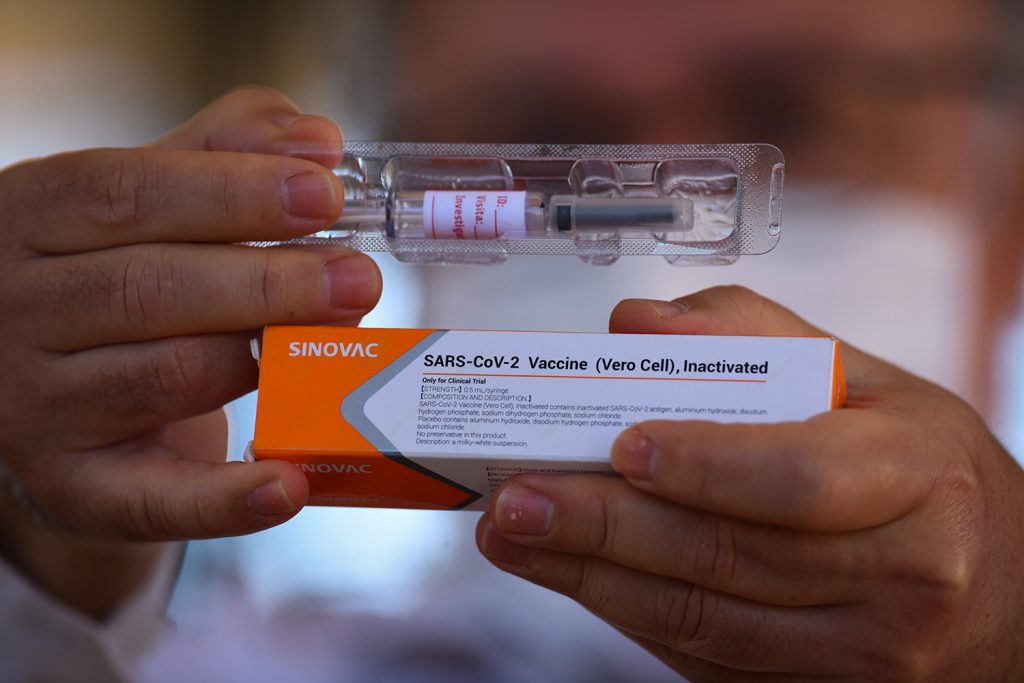
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu nesta sexta-feira, o pedido de autorização temporária de uso emergencial, em caráter experimental, da vacina Coronavac. O pedido foi enviado pelo Instituto Butantan, que no Brasil conduz os estudos da vacina desenvolvida pela empresa Sinovac. A agência estima que levará até dez dias para avaliar o pedido.
Sem detalhar dados, o Butantan afirma que a Coronavac tem eficácia de 78% para evitar casos leves da doença e de 100% par quadros moderados e graves. O Ministério da Saúde pretende comprar 100 milhões de doses da vacina em 2021, ou seja, toda a produção do instituto.
Leia a íntegra da nota divulgada pela Anvisa:
“A Anvisa recebeu nesta sexta-feira (8/1) o pedido de autorização temporária de uso emergencial, em caráter experimental da vacina Coronavac. O pedido foi enviado pelo Instituto Butantan, que no Brasil conduz os estudos da vacina desenvolvida pela empresa Sinovac.
A Anvisa já iniciou a triagem dos documentos presentes na solicitação e da proposta de uso emergencial que o laboratório pretende fazer.
As primeiras 24h serão utilizadas para fazer uma triagem do processo e checar se todos os documentos necessários estão disponíveis. Se houver informação importante faltando, a Anvisa pode pausar o prazo e solicitar as informações adicionais ao laboratório.
Para fazer sua avaliação, a Anvisa vai utilizar as informações apresentadas junto com o pedido e também as informações já analisadas pela Anvisa por meio da Submissão Contínua. A análise do pedido de uso emergencial é feita por uma equipe multidisciplinar, envolve especialista das áreas de registro, monitoramento e inspeção. A equipe vem atuando de forma integrada, com as ações otimizadas e acompanhadas pela Comissão que envolve 3 Diretorias da Agência.
A meta da Anvisa é fazer a análise do uso emergencial em até 10 dias, descontando eventual tempo que o processo possa ficar pendente de informações , a serem apresentadas pelo laboratório. Por fim, a Anvisa atua, conforme os procedimentos científicos e regulatórios, os quais devem ser seguidos por aqueles que buscam o a autorização de vacinas para serem utilizadas na população brasileira.”
Correio do Povo
Os comentários estão fechados no momento.
Leia também
Quinta-feira será de sol em todo o Rio Grande do Sul
- byJuliano Beppler da Silva
- 18 de abril de 2024
Mais Lidas
Identificado o jovem assassinado no interior de Bom Retiro do Sul
- 13 de abril de 2024














Ainda não há comentários