Anvisa anuncia registro de antiviral para tratar covid-19 e aprova registro definitivo de vacina de Oxford da Fiocruz
- porJuliano Beppler da Silva
- 12 de março de 2021
- 3 anos
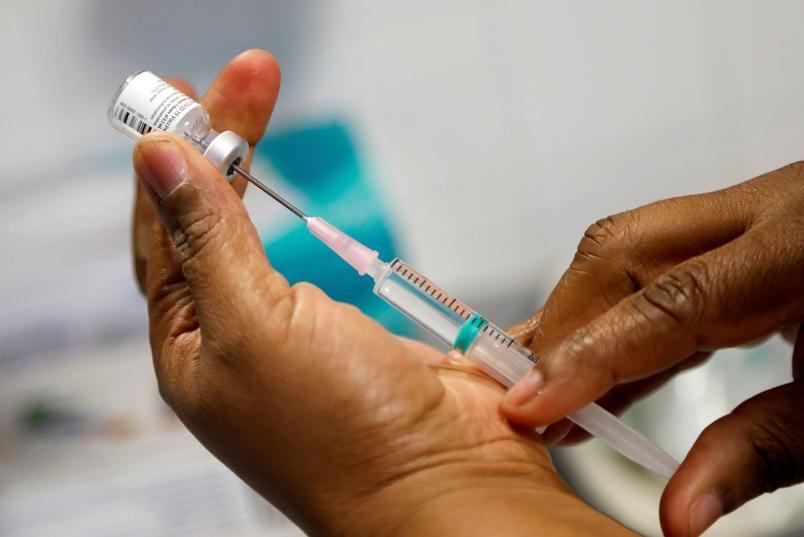
A Agência Nacional de Vigilância Sanitária (Anvisa) anunciou nesta sexta-feira, dia 12, o registro da vacina de Oxford/AstraZeneca produzida pela Fundação Oswaldo Cruz (Fiocruz). A decisão permite a entrega do produto que tem etapa de fabricação no país. O órgão também anunciou o registro do antiviral remdesivir.
Antes, a Anvisa já havia autorizado o uso emergencial da vacina de Oxford, mas a fabricada pelo Instituto Serum, da Índia. O registro não permite a venda ao setor privado, pois a Fiocruz tem apenas o Sistema Único de Saúde (SUS) e organismos multilaterais como clientes. A agência já havia registrado a vacina da Pfizer. Neste caso, o produto pode até mesmo ser vendido ao setor privado, mas a empresa afirma que só negocia agora com o Ministério da Saúde.
Fabricado pela Gilead, o remdesivir é usado no tratamento de pacientes hospitalizados com covid-19. É o primeiro medicamento que terá em bula a recomendação para o tratamento da covid-19. De acordo com o gerente-geral de Medicamentos da Anvisa, Gustavo Mendes, apesar de haver muita discussão sobre o uso do medicamento, a decisão foi tomada com base em “qualidade, segurança e eficácia”. O medicamento aprovado é indicado em casos mais graves da doença, nos quais os pacientes se encontram hospitalizados e entubados.
Originalmente destinado ao tratamento do vírus ebola, o remdesivir fazia parte do coquetel experimental administrado ao presidente dos Estados Unidos, Donald Trump, após contrair o coronavírus em setembro de 2020. O medicamento fez parte de um estudo liderado pela Organização Mundial da Saúde (OMS) em mais de 30 países que apontou que quatro antivirais utilizados contra a covid-19 são ineficazes: além do remdesivir, tratava de hidroxicloroquina, lopinavir/ritonavir (combinação) e interferon beta-1a.
Os medicamentos parecem “ter pouco ou nenhum efeito sobre os hospitalizados por covid-19, conforme indicado pelas taxas de mortalidade, início da assistência respiratória ou tempo de internação hospitalar”, explica o estudo Solidarity, que envolveu mais de 11 mil pessoas e publicado em 15 de outubro.
Segundo a Anvisa, o estudo da OMS se baseou mais na redução de mortalidade, mas as pesquisas que basearam a avaliação da agência tratavam do tempo de internação. Uma pesquisa bancada pelo Instituto Nacional de Saúde (NIH, na sigla em inglês) dos Estados Unidos mostrou que, em mais de mil pacientes, a droga reduziu o tempo de internação de 15 para 11 dias – não houve, no entanto, benefício significativo para reduzir a mortalidade.
A agência diz que o remédio é indicado para pessoas acima de 12 anos, que pesem mais de 40 quilos e que estejam em suporte de oxigênio, desde que não seja por ventilação mecânica invasiva. A terapia é indicada somente para pacientes hospitalizados e monitorados.
No Brasil, sem a liberação, o remédio só podia ser empregado quando um médico receitava a substância para uso individual de um paciente – ou seja, um hospital não podia comprar remdesivir e deixá-lo no estoque para qualquer pessoa. Cada paciente precisava pedir autorização da Anvisa e importar para uso próprio, em processo semelhante à compra de remédios raros de outro país.
GaúchaZH
Os comentários estão fechados no momento.
Leia também
Mais Lidas
Identificado o jovem assassinado no interior de Bom Retiro do Sul
- 13 de abril de 2024
Mais Recentes
Frente fria avança no Rio Grande do Sul, trazendo chuva nesta terça-feira
- 15 de abril de 2024
- 2 horas
Brigada Militar estoura desmanche de veículos roubados, em Taquari
- 15 de abril de 2024
- 8 horas
Caminhão perde freio e colide frontalmente com caminhonete na RSC-453, em Westfália
- 15 de abril de 2024
- 13 horas














Ainda não há comentários